近日,我院江育虹副教授研究小组在国际TOP期刊ACS Nano (IF=17.1)上发表免疫佐剂机制领域论文“The Distinct Properties of Polysaccharide Nanoparticles Tune Immune Responses against mRNA Antigen via Stimulator of Interferon Genes-Mediated Autophagy and Inflammasome”,报道了多糖佐剂纳米化的免疫增强机制。江育虹副教授为通讯作者,2020级硕士研究生吴月为第一作者,硕士研究生梁晓钰参与部分工作,茆灿泉教授给予重要指导。

mRNA抗原面临易降解、难进入细胞、过度细胞因子释放等问题,纳米载体则可保护和递送mRNA增强疫苗疗效。同时,有研究对mRNA进行核苷碱基修饰,提高其稳定性的同时也降低了其免疫原性,导致修饰后的mRNA需要佐剂的帮助。不难发现纳米化的佐剂既能有效纳米递送mRNA,又可作为佐剂增强其抗原的免疫应答。近年来,脂质纳米粒LNP被应用于mRNA新冠疫苗,但仍表现出一定的系统毒性,故急需探索安全低毒的纳米佐剂材料。多糖是一类天然的佐剂材料,能增强蛋白、多肽等抗原的免疫应答,却在mRNA疫苗中的应用甚少。该研究小组探索了不同性状的多糖佐剂纳米化后增强mRNA抗原的免疫效果及机制,旨在揭示纳米多糖的免疫增强机制,为设计mRNA疫苗潜在的多糖佐剂提供了理论和实验基础。
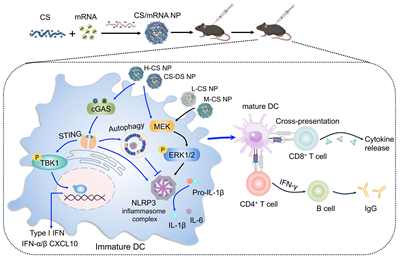
该研究发现多糖纳米化后可成功递送mRNA进入免疫细胞,不同分子量的多糖纳米粒均能提高mRNA抗原的摄取、交叉提呈以及DC细胞成熟,且增强效率随着多糖分子量的增加而上升。高分子量的多糖纳米粒激活强烈的STING信号和自噬通路,以及适度的NLRP3炎症小体信号转导,进而在体内外对mRNA抗原具有显著的免疫增强效果。相比之下,低分子量的多糖纳米粒虽能诱导较强的NLRP3信号但对STING或自噬通路作用较弱,无法诱导强烈的免疫应答。表明纳米多糖的免疫增强作用机制高度依赖于其分子量等性状,揭示了纳米多糖的分子量依赖性的免疫增强机制。
该研究获得国家自然科学基金青年项目(82003784)、中央高校基础研究医工结合培育专项(2682022ZTPY037)、西南交通大学大型仪器设备开放测试基金(2022SRII-046)等资助,同时得到生命学院茆灿泉教授、生命学院科研平台、西南交通大学分析测试中心等的大力支持。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c07632
